Badania radiobiologiczne
Biologiczne oddziaływanie promieniowania o wysokim LET
Janusz Braziewicz (1), Joanna Czub (1), Jan Dyczewski (2), Marian Jaskóła (3), Andrzej Korman (3), Ludwik Pieńkowski (4), Piotr D. Rybak (2), Zygmunt Szefliński (2), Andrzej Wójcik (5)
(1) Instytut Fizyki, Akademia Świętokrzyska, Kielce
(2) Instytut Fizyki Doświadczalnej UW, Warszawa
(3) Instytut Problemów Jądrowych, Świerk
(4) Środowiskowe Laboratorium Ciężkich Jonów, Warszawa
(5) Instytut Biologii, Akademia Świętokrzyska, Kielce
Założenia naukowe
Celem niniejszego projektu jest poznanie fizycznych mechanizmów zmian genetycznych indukowanych w jądrze komórkowym w wyniku przejścia ciężkiego jonu przy różnicowaniu liniowego transferu energii (LET). Dysponując energią jonów o energii 10 MeV/u z cyklotronu ŚLCJ w Warszawie możemy skupić się na analizie skutków przejścia ciężkiego jonu o energiach z obszaru piku Bragga (E < 4MeV/u) przez materiał biologiczny. W tym przypadku liniowy transfer energii osiąga najwyższe wartości sięgające 1MeV/μm [1]. Efekty radiobiologiczne wywołane oddziaływaniem wiązki ciężkich jonów o wysokim ładunku są przedmiotem zainteresowania specjalistów terapii nowotworowej i specjalistów ochrony radiologicznej przy długich misjach kosmicznych [2,3]. Ze względu na tzw. odwrotny profil dawki, uzyskuje się wzrost dawki pochłoniętej w miarę penetracji tkanki przez naładowane jony. Umożliwia to uzyskanie wyższych dawek w obszarze nowotworu przy terapii jonowej niż przy terapii fotonowej.
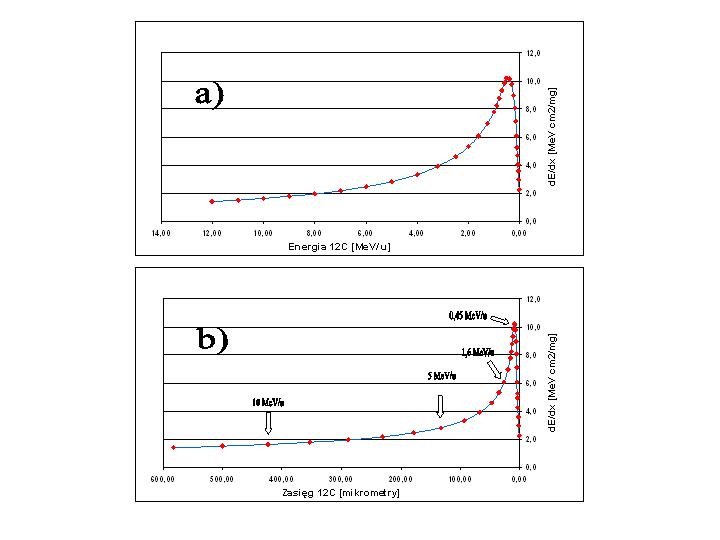
Rysunek 1: dE/dx dla jonów węgla w wodzie w funkcji energii na nukleon (a) i w funkcji zasięgu z zaznaczeniem wybranych energii (b). W/g Northcliffe and Schilling [4]
Biologiczne działanie promieniowania o wysokim LET budzi żywe zainteresowanie w związku z jego wykorzystaniem w radioterapii oraz narażeniem personelu lotniczego i załóg misji kosmicznych. Ze względu na wysoką względną skuteczność biologiczną ciężkich jonów oraz korzystny rozkład dawki w tkance, ich zastosowanie w terapii nowotworów (terapia hadronowa) może okazać się bardziej skuteczne od terapii protonowej. Duży wkład ciężkich jonów w promieniowaniu kosmicznym powoduje wyższe, na jednostkę dawki, ryzyko efektów stochastycznych niż w przypadku promieniowania ziemskiego. Dotyczy to zarówno personelu obsługującego loty samolotowe jak i rosnącą grupę astronautów. Osobnicza wrażliwość komórek naszego organizmu na działanie promieniowania jonizującego jest zróżnicowana [4]. Fakt ten ma zasadnicze znaczenie zarówno w radioterapii pacjentów jak i ochronie radiologicznej osób narażonych zawodowo na działanie promieniowania. Pacjenci poddawani radioterapii otrzymują z góry ustalone dawki promieniowania. Wysokość stosowanej dawki terapeutycznej ustala się dla danego rodzaju nowotworu na podstawie wyników wyleczalności danego typu schorzenia z uwzględnieniem pewnego, dopuszczalnego poziomu ryzyka poważnego odczynu popromiennego zdrowych tkanek [5]. Rozpoznanie pacjentów promieniowrażliwych przed rozpoczęciem terapii pozwoliłoby na ograniczenie poważnych odczynów popromiennych przez indywidualne dostosowanie planu radioterapii lub jej zaniechanie na korzyść innej formy terapii [6,7] . W dziedzinie ochrony radiologicznej limity dopuszczalnych dawek opierają się na szacunku ryzyka dla “przeciętnego” człowieka. Analogicznie jak w przypadku pacjentów, narażenie zawodowe na promieniowanie w zakresie dopuszczalnych dawek może być dla osób o wysokiej promieniowrażliwości osobniczej źródłem ponadprzeciętnego ryzyka dla zdrowia, którego można by uniknąć, gdyby istniała możliwość rozpoznania takich osób przed ich narażeniem. Nie dziwi więc, że badania ostatnich lat skupiły się na szukaniu metod umożliwiających określenie osobniczej promieniowrażliwości. Uwarunkowania osobniczej wrażliwości na czynniki uszkadzające DNA, takie jak promieniowanie jonizujące mogą mieć różne podłoże. Znane są defekty białek nadzorujących integralność i naprawiających uszkodzenia DNA w takich zespołach chorobowych jak ataksja teleangiektazja (nadwrażliwość zarówno w homo-, jak w heterozygotach), zespół Nijmegen lub niedokrwistość Fanconiego [8,9]. Ponadto obserwuje się przypadki nasilonych reakcji po radioterapii u chorych, u których nie stwierdzono takich zespołów chorobowych [10]. Wydaje się, że najbardziej obiecującym wskaźnikiem osobniczej promieniowrażliwości są aberracje chromosomowe analizowane w limfocytach ludzkich. Ostatnie prace potwierdzają zróżnicowany poziom popromiennych aberracji w limfocytach zdrowych dawców [11] oraz wskazują na korelację między poziomem popromiennych aberracji i reakcją pacjenta na radioterapię [12]. We wszystkich opublikowanych dotychczas badaniach nad osobniczą promienio-wrażliwością napromieniano limfocyty promieniowaniem o niskim LET. Zdumiewa brak danych na temat promieniowania o wysokim LET. Nie wiadomo, czy limfocyty różnych dawców reagują z różną wrażliwością na promieniowania o wysokim LET. Nie wiadomo też, czy istnieje korelacja między wrażliwością limfocytów na promieniowanie o niskim i wysokim LET. Ze względu na wzrastające narażenie ludzi na ciężkie jony wydaje się, że badania nad oceną osobniczej wrażliwości na promieniowanie o wysokim LET są jak najbardziej uzasadnione. Choć istnieją już modele oddziaływania promieniowania z komórkami oparte na fizyce jonizacji [13], to mechanizmy zmian genetycznych są na tyle złożone, że istnieją jedynie uproszczone oszacowania wpływu promieniowania na te zmiany. Jak wskazują obliczenia Monte Carlo dla trajektorii ciężkiego jonu penetrującego materię [3], jon deponuje swoją dawkę w radialnym obszarze odległym od trajektorii nie więcej niż kilka nm. Jak obliczamy dalej jony 12C deponują najwyższą dawkę w ostatnich kilkudziesięciu μm swojej trajektorii.
Literatura
[1] L.C. Northcliffe and R.F. Schilling. Range and stopping power for heavy ions. Nuclear Data Tables A7,233 (1970).
[2] Induction of DNA strand breaks by heavy ions G. Taucher Scholz, J. Heilmann, G. Kraft, Nucl. Instr. and Meth. in Phys. Res. B107,318(1996)
[3] Kraft G. Radiobiological Effects of Highly Charged Ions. The Physics of Highly and Multiply Charged Ions Academic Publisher (Academic Publisher): (2002)
[4] Bentzen SM, Hendry JH (1999) Variability in the radiosensitivity of normal cells and tissues. Report from a workshop organised by the European Society for Therapeutic Radiology and Oncology in Edinburgh, UK, 19 September 1998. Int J Radiat Biol 75: 513-517
[5] Ramsay J, Birell G (1995) Normal tissue radiosensitivity in breast cancer patients. Int J Radiation Ocology Biol Phys 31: 339-344
[6] Burnet NG, Nyman J, Turesson I, Wurm R, Yarnold JR, Peacock JH (1994) The relationship between cellular radiation sensitivity and tissue response may provide the basis for individualising radiotherapy schedules. Radiother Oncol 33: 228-238
[7] Tucker SL, Geara FB, Peters LJ, Brock WA (1996) How much could radiotherapy dose be altered for individual patients based on a predictive assay of normal-tissue radiosensitivity? Radiother Oncol 38: 103-113
[8] Bernhard EJ, Maity A, Muschel RJ, McKenna WG (1995), Effects of ionizing radiation on cell cycle progression. Radiat Environ Biophys 34: 79-83 [9] Hall J, Angele S(1999), Radiation, DNA damage and cancer. Mol Med Today 5:157-164
[10] Müller W-U, Bauch T, Stüben G, Sack H, Streffer C (2001), Radiation sensitivity of lymphocytes from healthy individuals and cancer patients as measured by the comet assay. Radiat Environ Biophys 40: 83-89
[11] Smart V, Curwen GB, Whitehouse CA, Edwards AA, Tawn EJ (2003), Chromosomal radiosensititvity: a study of the chromosomal G2 assay in human peripheral blood lymphocytes indicating significant inter-individual variability. Mutat Res 528: 105-110
[12] Hoeller U, Borgmann K, Bonacker M, Kuhlmey A, Bajrovic A, Jung H, Alberti W, Dikomey E (2003), Individual radiosensitivity measured with lymphocytes may be used topredict the risk of fibrosis after radiotherapy for breast cancer. Radiother Oncol 69: 137-144
[13] Computation of cell survival in heavy ion beams for therapy. The model and its approximation, M. Scholz, A.M. Kellerer, W. Kraft-Weyrather, G. Kraft Radiat. Environ. Biophys. 36,59-66(1997)
Opis układu pomiarowego
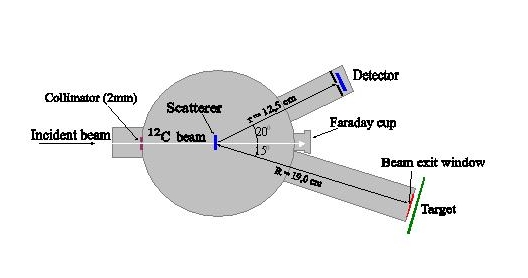
Poznanie fizycznych mechanizmów zmian genetycznych wymaga systematycznych badań. Do przeprowadzenia planowanych badań budowane jest stanowisko eksperymentalne, które zostanie wykorzystane zarówno w Środowiskowym Laboratorium Ciężkich Jonów w Warszawie na wiązkach jonów o wysokim LET jak również w eksperymentach do badania oddziaływania promieniowania o niskim LET w Świętokrzyskim Centrum Onkologii w Kielcach. W proponowanych wstępnych pomiarach w ŚLCJ wykorzystano wiązki jonów 12C o energii 100 MeV degradowane przez folie do energii 20 MeV z krokiem 20 MeV. Schemat układu pomiarowego, który został zbudowany i zainstalowany na jonowodzie cyklotronu oraz przetestowany w eksperymencie z czerwca 2004, przedstawiono na rysunku 2. Podstawowymi elementami układu są: skaningowy stolik x-y do badanych tarcz biologicznych, układ pomiaru natężenia i rozkładu wiązki, układ pomiaru deponowanej dawki promieniowania. Dodatkowo do analizy wyników naświetlania będzie wykorzystywany układ pomiarowy do analizy przeżycia i analizy zaburzeń chromosomowych. Podjęcie planowanych badań radiobiologicznych na wiązce cyklotronu warszawskiego narzucało pewne ograniczenia, które uwzględniono w projektowanym układzie eksperymentalnym:
a) Pomiar efektów biologicznych wywołanych oddziaływaniem ciężkich jonów musi być przeprowadzony na stanowisku pomiarowym na zewnętrznej wiązce jonów. Dlatego też, w układzie próżniowym zawierającym cienką folię na wyjściu jonowodu zastosowano szybki zawór automatycznie odcinający próżnię.
Rysunek 2: Układ pomiarowy użyty w eksperymencie z 3-4 czerwca 2004.
b) Folia havarowa o grubości 1.7 mg/cm2 zamyka bezpiecznie próżnię w jonowodzie na powierzchni ok. 1.5 cm2. Dlatego też okno wyjściowe jonowodu, za którym umieszczane są tarcze pomiarowe, ma wymiary 12x14mm co daje powierzchnię ok. 1.7cm2. W zaprojektowanym układzie pomiarowym, z uwagi na to, że dE/dx=1,1 MeVcm2/mg dla jonów 12C o energii 10 MeV/u przechodzących przez folię havarową o grubości 1.7mg/cm2, straty energii jonów w oknie wyjściowym jonowodu wynoszą 2 MeV co oznacza redukcję ich energii o 2/12 czyli ok 0,2 MeV/u. Dla wyprowadzonej wiązki jonów o energii 9,8 MeV/u otrzymujemy jej zasięg w wodzie 42mg/cm2 czyli 0,42 mm (Rys. 1). Zasięg takiej wiązki w powietrzu byłby 40 cm.
c) Stolik skaningowy X-Y, na którym umieszczane są tarcze pomiarowe posiada sterowanie komputerowe umożliwiające otrzymanie jednorodnego powierzchniowo rozkładu dawki na naświetlanych tarczach z dokładnością lepszą niż 2.5% na całej powierzchni o Φ=10cm.
d) Pożądana w planowanych badaniach radiobiologicznych tego typu jest wiązka pionowa, jednakże bardzo cienkie warstwy biologiczne można utrzymywać na podkładce w pozycji pionowej, a to pozwala wykonywać badania z wiązką poziomą, dostępną w ŚLCJ w Warszawie.
e) Monitorowanie wiązki i jej rozkładu jest dokonywane za pomocą układu detektora ciężkich jonów rozpraszanych pod kątem 20o jonów, detektorów termoluminescencyjnych oraz kalibrowanych folii rentgenowskich.
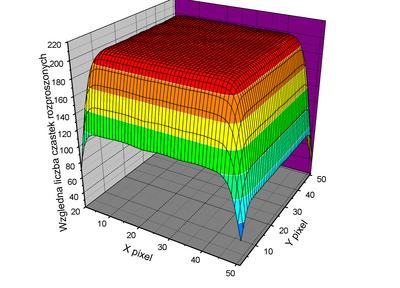
W wyniku przeprowadzonych pomiarów wstępnych otrzymano zaplanowaną 3% jednorodność rozkładu prądu wiązki jonów 12C o energii 9.8 MeV/amu na tarczy o średnicy 6 cm.
Rysunek 3: Rozkład natężenia wiązki w tarczy o wymiarach 60 *60 mm dla omawianego układu eksperymentalnego.
Zamierzenia eksperymentalne
W trakcie planowanych pomiarów w końcu roku 2004 i w roku 2005 przeprowadzone zostaną badania kalibracyjne układu obejmujące:
- Pomiar rozkładu dawki promieniowania w naświetlanym obszarze o promieniu 6 cm.
- Pomiar bezwzględny dawki deponowanej w badanej tarczy.
- Pomiar rozkładu energetycznego ciężkich jonów po przejściu przez degradator energii.
- Analiza wpływu podłoża i otoczenia na dawkę deponowaną w materiale biologicznym.
W aspekcie badań biologicznych, wykonywanych w następnym etapie eksperymentu, planujemy napromienić limfocyty zdrowych dawców jonami o energii w zakresie MeV/u oraz promieniowaniem gamma (Co-60). Badania obejmą:
- Analizę aberracji niestabilnych (chromosomów dicentrycznych i pierścieni), widocznych pod mikroskopem świetlnym na preparatach wybarwionych metodą FPG (Fluorescence Plus Giemsa). Metoda ta pozwala jednoznacznie rozpoznać mitozy w pierwszym popromiennym podziale. Dokładne rozpoznanie mitoz w pierwszym popromiennym podziale jest konieczne dla poprawnej ilościowej oceny częstości aberracji.
- Analizę aberracji niestabilnych metodą malowania chromosomów (FISH – fluorescence in situ hybridization). Ponieważ nie można stosować metody FPG równocześnie z metodą FISH, limfocyty będą zmuszane do wejścia w mitozę metodą przedwczesnej kondensacji chromatyny (PCC – Premature Chromosome Condensation). Planujemy analizę aberracji w pomalowanych chromosomach 2 i 8.
Oczekuje się, że zbadanie w opisany sposób limfocytów pochodzących od 5-10 dawców pozwoli ocenić, czy istnieje korelacja między wrażliwością na promieniowanie o różnym LET. Badania prowadzone metodą FISH umożliwią oceną aberracji stabilnych, których nie widać pod mikroskopem świetlnym. Dodatkowo, pozwolą ocenić, czy istnieje osobniczo zróżnicowana wrażliwość wybranych chromosomów na promieniowanie o różnym LET.